
| 형식 | 전기장치 | 제목 | 축전지 구조 및 기능 |
|---|---|---|---|
1. 축전지 구조 및 기능 납산 축전지는 6개의 단전지 (cell ; 방)로 이루어진 케이스가 있고 각 단전지마다 양극판과 음극판, 격리판 및 전해액이 들어 있다. 또한 양극판은 음극판보다 작용이 활발하여 쉽게 파손되므로 화학적인 평형을 고려하여 음극판을 한 장 더 많이 둔다.
배터리의 구조
1.1. 납산 축전지의 케이스(case) 케이스는 몸체를 이루는 부분으로 재질은 플라스틱으로 제작하며, 12V 축전지의 것은 6칸으로 나누어져 있다. 위의 커버에는 증류수나 전해액 주입을 하는 주입구가 있으며 벤트 플러그가 설치되기도 하며 축전지 내부에서 발생한 산소와 수소가스를 방출한다. 그러나 최근에 사용하고 있는 MF축전지에서는 벤트 플러그를 사용하지 않는다. 각 셀의 밑 부분에는 극판의 작용물질의 탈락이나 침전물 축적에 의한 단락을 방지하기 위한 엘리먼트 레스트(element rest)가 마련되어 있다. 축전지의 커버와 케이스의 청소는 탄산소다(탄산나트륨)와 물 또는 암모니아수로 한다. 1.2. 납산 축전지의 격리판 격리판은 양극판과 음극판 사이에 끼워져 양쪽 극판의 단락을 방지하는 일을 하며, 격리판은 플라스틱(합성수지)을 주로 사용하지만 강화섬유나 고무를 사용하기도 한다. 그리고 격리판의 구비조건은 다음과 같다. ① 비 전도성 일 것 ② 구멍이 많아서 전해액의 확산이 잘 될 것 ③ 기계적 강도가 있고, 전해액에 부식되지 않을 것 ④ 극판에 좋지 못한 물질을 내 뿜지 않을 것
1.3. 납산 축전지의 극판군 극판은 몇 장의 납과 안티몬 합금이며 양극판은 과산화납(PbO2)으로 음극판은 해면상납(海綿狀鉛, Pb) 조립하여 접속 편에 용접하여 1개의 단자(terminal post)와 일체가 되도록 한 것이다. 이와 같이 하여 만든 극판 군을 1셀(cell)이라 하며, 완전 충전되었을 때 약 2.1V의 기전력을 발생한다. 따라서 12V 축전지의 경우에는 6개의 셀이 직렬로 연결되어 있다. 그리고 극판의 장수를 늘리면 축전지 용량이 증가하여 이용전류가 많아진다.
극판군의 구성 1.4. 납산 축전지의 극판 극판에는 양극판과 음극판이 있으며, 격자(grid)에 납 가루나 산화납을 묽은 황산으로 개어서 만든 반죽(paste)으로 충전하고 건조, 화학적 조성 등의 공정을 거쳐서 양극판은 과산화납(PbO2), 음극판은 해면상납(Pb)으로 한 것이다. 격자의 재질은 납(Pb)과 안티몬(Sb)의 합금이며, 과산화납이나 해면상납의 탈락을 방지하고 작용물질과의 전기 전도작용을 한다. 과산화납은 암갈색이며, 구멍이 많아서 전해액의 확산 침투가 쉽지만 결합력이 부족하기 때문에 사용함에 따라 결정성 입자가 파괴, 미세화 하여 극판에서 탈락된다. 음극판도 구멍이 많으며 반응성질이 풍부하며 결합력이 커 탈락은 없으나 사용함에 따라 결정이 성장하여 구멍 수가 줄어든다. 양극판의 결정성 입자가 탈락하거나 음극판의 구멍 수가 감소하면 축전지의 수명을 다한 것이다. 1.5. 커버와 벤트 플러그(cover & vent plug) 커버와 케이스는 접착제로 접착하여 기밀을 유지한다. 또 커버의 가운데에는 전해액이나 증류수를 주입하거나, 비중계나 온도계를 넣기 위한 구멍과 이것을 막아 두기 위한 벤트 플러그(vent plug)가 있으며 이 플러그의 중앙이나 옆에는 작은 구멍이 있어 축전지 내부에서 발생한 산소와 수소가스를 방출한다. 그러나 최근에 사용하고 있는 MF축전지에서는 벤트 플러그를 사용하지 않는다. 1.6. 납산 축전지의 단자(terminal post) 단자는 납합금이며, 외부회로와 확실하게 접속되도록 하기 위해 테이퍼(taper)되어 있다. 양극단자는 양극판이 과산화납이므로 쉽게 산화가 발생되어 부식되기 쉽다. 만약 부식되었을 경우에는 깨끗이 세척한 후 그리스(greese)를 얇게 발라 준다. 그리고 양극과 음극단자에는 문자, 색깔 및 크기 등으로 표시하여 잘못 접속되는 것을 방지하고 있다. 단자의 식별방법은 다음과 같다. ① 양극은 (+), 음극은(-)의 부호로 분별한다. ② 양극은 빨간색, 음극은 검은색의 색깔로도 분별한다.
축전지 단자 ③ 양극은 지름이 굵고, 음극은 가늘다. ④ 양극은 POS, 음극은 NEG의 문자로 분별한다. ⑤ 부식물이 많은 쪽이 양극이다. 또, 축전지 단자로부터 케이블을 분리할 경우에는 반드시 접지단자의 케이블을 먼저 분리하고, 설치할 경우에는 나중에 설치하여야 한다.
1.7. 전해액(Electrolyte) 전해액은 순도가 높은 묽은황산(H2SO4)을 사용한다. 전해액은 극판과 접촉하여 충전을 할 때에는 전류를 저장하고, 방전될 때에는 전류를 발생시켜 주며, 셀 내부에서 전류를 전도하는 작용도 한다. 전해액의 비중은 20℃에서 완전 충전되었을 때 1.280이며 이를 표준 비중이라 한다. 전해액이 표준 비중일 때 황산의 도전성이 가장 높다. 또 완전 방전되었을 경우에는 비중이 1.050 정도이다. 그리고 전해액은 온도가 상승하면 비중이 작아지고, 온도가 낮아지면 비중은 커진다. 전해액 비중은 온도 1℃ 변화에 대하여 0.0007이 변화한다. S20 : 표준 온도 20℃로 환산한 비중, S t :t℃에서 실제 측정한 온도, t : 측정할 때의 전해액 온도 ① 비중에 의한 충전 상태의 판정비중의 측정은 비중계를 사용한다. ② 전해액의 비중은 온도가 높으면 비중은 작아지고, 낮으면 커진다. ③ 비중은 전해액의 온도를 병기하든가 표준 온도(20℃)로 환산하여 표시한다. ④ 방전 상태에서는 비중의 저하에 비례하여 전해액의 빙결 온도가 올라간다. ⑤ 전해액이 빙결되면 극판의 작용물질이 붕괴되어 사용을 할 수 없다. ⑥ 기온이 낮을 때에는 빙결방지를 위해 완전충전 상태를 유지하는 것이 좋다. ⑦ 전해액을 제조할 때에는 화학 작용을 일으키지 않는 용기(질그릇 등)를 사용하며, 물에 황산을 조금씩 부으면서 유리 막대 등으로 천천히 저어서 혼합 한다(황산은 발열과 폭발성 있으므로 위험하다). 이때 혼합비율은 물 60%와 황산 40% 정도로 한다. ⑧ 전해액의 양은 15~30 일마다 정기적 점검하며 극판 위 10~13mm가 정상이다. ◎ 설페이션 현상 축전지의 방전상태가 일정 한도 이상 오랫동안 진행되어 극판이 결정화되는 현상을 말하며 그 원인은 다음과 같다. ① 전해액의 비중이 너무 높거나 낮다. ② 전해액이 부족하여 극판이 노출되었다. ③ 불충분한 충전이 되었다. ④ 축전지를 방전된 상태로 장기간 방치하였다. ◎ 페러데이 법칙 전해액의 비중으로 충.방전량을 추정할 수 있는 근거는 페러데이 법칙에 의해 1AH의 방전량에 대해 전해액 중의 황산이 3.66g소비되고, 물이 0.67g이 생성된다. 또 같은 1AH의 충전량에 대해서도 0.67g의 물이 소비되고, 3.66g의 황산이 생성된다. 1.8. 축전지의 화학 작용 (1) 배터리의 방전 아래 그림과 같이 내부 변화를 일으켜 전해액 가운데의 황산이 양극판과 음극판의 양극판과 작용한다. 방전이 진행되면 이에 따라 극판과 황산이 화합하여 양극판이 모두 황산납(PbSO4)이 된다. 한편 전해액인 묽은 황산의 수소는 양극판 속에 산소와 화합하여 물을 만든다. 따라서 전해액의 비중은 방전에 따라 점점 낮아진다. 양극판 : 과산화납(PbO2) → 황산납(PbSO4) 음극판 : 해면상납(Pb) → 황산납(PbSO4) 전해액 : 황산(H2SO4) → 물(H2O) 방전 중의 화학 작용 (2) 배터리의 충전 아래 그림과 같이 발전기나 충전기를 접속하여 전류가 흐르면 극판과 묽은 황산이 화학변화를 일으켜 극판 표면에 부착되어 있던 황산납이 분해되어 전해액 속에 방출된다. 이에 따라 양극판은 다시 과산화납이 되고 음극판은 해면상납이 된다. 또 전해액은 양극판에서 황산이 나오기 때문에 그 비중이 점점 높아지고 양극과 음극 사이의 전압도 상승된다.
충전 중의 화학 작용 충전이 완료되면 그 이후의 충전 전류는 전해액 속의 물을 전기 분해하여 양극판에서는 산소를, 음극판에서는 수소를 발생시킨다. 양극판 : 황산납(PbSO4) → 과산화납(PbO2) 음극판 : 황산납(PbSO4) → 해면상납(Pb) 전해액 : 물(H2O) → 황산(H2SO4)
|
|||












.bmp)
.bmp)
.bmp)
.bmp)
.bmp)
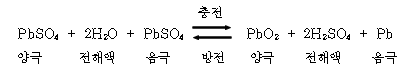

.jpg)
.jpg)


